单细胞ATAC-seq
产品介绍
单细胞ATAC测序(scATAC-seq)是基于10x genomics平台的微流控和油滴包裹技术,在单细胞水平对细胞染色质开放区域进行检测的新技术,可用于绘制细胞染色质开放区的单细胞图谱,是一种高分辨率研究染色质开放程度与DNA结合蛋白调控基因的表达网络,在单细胞水平研究表观遗传学的有效手段。
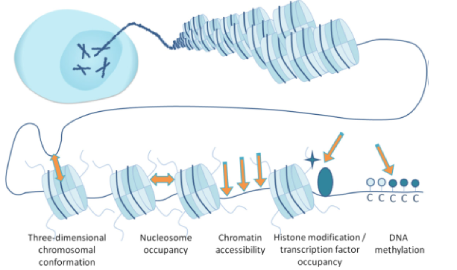
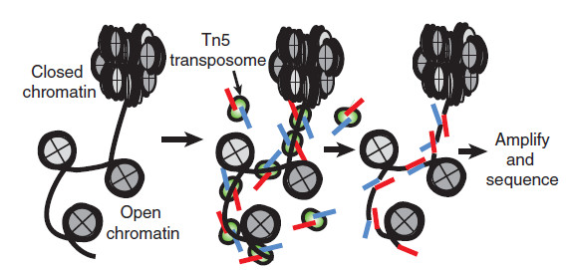
染色质可及性的早期研究技术是ATAC-seq(Assay for transposase-accessible chromatin with high-throughput sequencing),该技术可进行高通量测序的染色质可及性(开放性)研究,而染色质开放区域一般是染色质中呈松散状态、可发生DNA复制和基因转录的区域,ATAC-seq 使用改造 Tn5转座酶,捕获染色质开放区,将测序接头引入开放染色质的两端,用于表观遗传、基因调控研究。2015 年 Science 和Nature发表论文先后提出利用单细胞 ATAC-seq 技术对染色质可及性进行检测,探索细胞转录调控机制,解决了以往存在的细胞异质性难题,极大的扩大了ATAC-seq 技术的应用范围。同时2018年10月,10x Genomics 推出的 Chromium 单细胞 ATAC 解决方案提供了一种全面的、可扩展的方法来研究分析单个样本中成百上千个细胞中染色质的开放情况。可在单细胞水平进行多组学联合分析,深度挖掘细胞异质性表观遗传调控机理。
技术原理
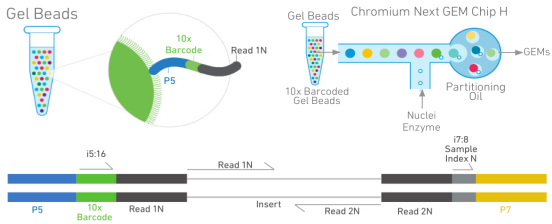
单细胞ATAC测序是通过改造Tn5转座酶对混合的细胞核悬液进行核 DNA 的切割,然后使用微流控芯片将溶液中的细胞核包裹到油滴中,形成纳米级的凝胶微珠乳浊液(GEMs)。采用 10x barcode条形码,对每个细胞核切割的 DNA 加上唯一的10x barcode条形码。通过文库构建,测序,最终根据 10x barcode 条形码将测序得到的序列关联到每个单独的细胞核上。
产品优势
低成本
高分辨率
高通量
高效率
大数据
适用范围广
经验丰富
应用方向
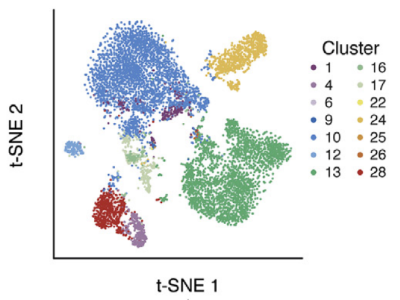
结果展示
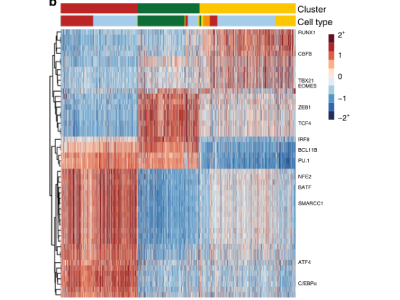
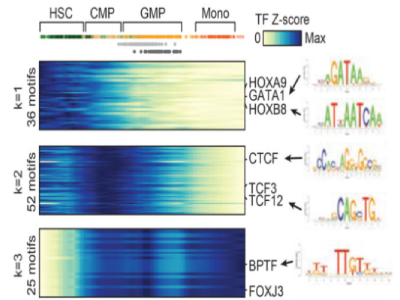
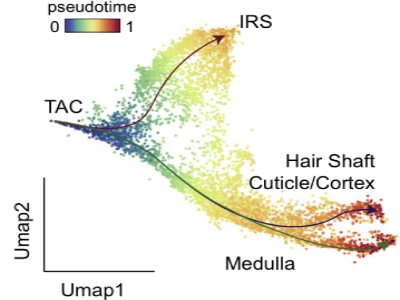
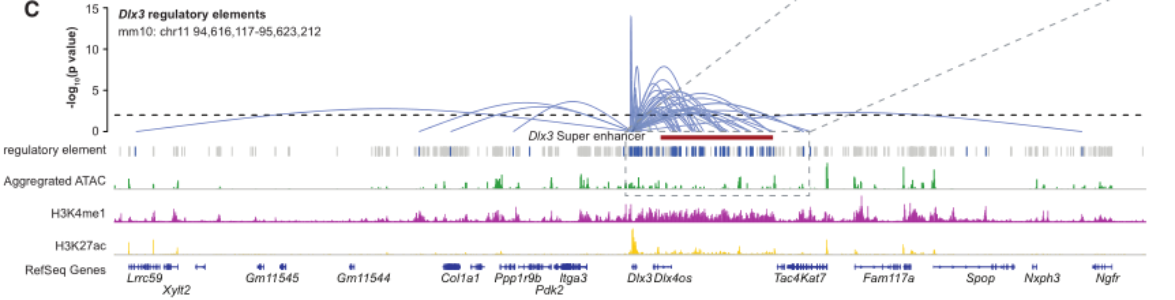
常见问题
如何选择单细胞ATAC-seq测序数据量?
建议每个细胞核测 25000 read pairs,一般数据量为25~50G可达到最佳测序数据量和测序饱和。
对于10X scATAC-seq的样本要求?
(1)物种要求:人、小鼠、其他物种要求有较高质量的基因组;
(2)样本类型:细胞系,原代细胞,冻存细胞,新鲜组织等可制备高质量单细胞悬液;
(3)样本要求:单细胞悬液,采用活细胞,细胞活性>80%,细胞浓度700~1200 cells/μL,细胞总量可达1*10^6个,细胞成团率<5%;血液采用EDTA 抗凝的全血(不可肝素抗凝),>5ml;组织采用新鲜组织,200mg。
(4)细胞核抽提质量要求:活细胞比例<5%(台盼蓝等染色可观测);显微镜下,细胞核形态完整;尽量去除细胞碎片和细胞团。
单细胞ATAC-seq细胞分群和scRNA-seq有何不同?
单细胞ATAC测序根据染色质的可及性特征进行降维聚类细胞分群,得到的细胞分群不依赖于基因表达,对于一些低丰度表达的细胞灵敏性更高,可通过染色质开放区域挖掘更多低丰度表达的细胞。
单细胞转录测序和单细胞ATAC-seq可以联合分析吗?
可以。
目前关于scRNA-seq和scATAC-seq联合分析有两种情况:
(1)细胞量足够的情况下,一份单细胞悬液可以分成两份,一部分进行10X scRNA,另一部分抽核后进行10X scATAC。分别进行scRNA-seq和scATAC-seq,根据染色质可及性和基因表达联合分析挖掘更多具有表观遗传潜力的基因调控网络。
(2)10x Genomics新的单细胞多组学解决方案:Chromium单细胞多组学ATAC+基因表达,实现了同一细胞同时分析基因表达和开放染色质,将得到ATAC文库和基因表达文库测序原始数据加载到Cell Ranger ARC分析流程中,并通过Loupe Browser进行可视化,将基因表达读数与潜在的调控功能相关联。这种方式得到的染色质开放性和基因表达关系更紧密客观真实,有助于寻找基因表达调控关系。
经典案例
?scATAC-seq绘制哺乳动物染色质可及性图谱
文中对13个成年小鼠组织的约100000个单细胞进行ATAC测序分析,鉴定出85种不同的染色体可接近性模式及近400000个差异可接近性元件。利用测序数据,将调控元件及其靶基因关联起来,基于转录因子特异性定义亚群,探索细胞染色质可接近性异质性,并将小鼠染色质可及性与人类全基因组关联,为哺乳动物细胞亚群基因调控相关的深入研究提供了依据。
文献原文:A Single-Cell Atlas of In Vivo Mammalian Chromatin Accessibility. 2018, Cell, IF=38.637







 京公网安备 11011302003368号
京公网安备 11011302003368号