2025年1月,青岛农业大学葛伟教授与沈伟教授团队在学术期刊《Genome Biology》上发表了一篇题为《Spatiotemporal dynamics of early oogenesis in pigs》的研究论文。该研究利用了单细胞RNA测序和空间转录组技术,解析了猪早期卵子发生中的基因表达及空间组织特征。研究发现,猪生殖细胞在卵巢中呈“皮质到髓质”分布,且与人类卵子发生过程相似,表明猪是研究人类卵子发生的良好模型。RNA速度分析揭示了颗粒细胞谱系特征,空间共定位分析和细胞通讯分析显示皮质与髓质区域生殖细胞与体细胞通讯模式不同,特别是NOTCH信号通路和ECM蛋白在调控中起关键作用,强调了卵巢微环境对生殖细胞命运的重要性。

文章标题:Spatiotemporal dynamics of early oogenesis in pigs
期刊名称:Genome Biology
影响因子:10.1
合作单位:青岛农业大学
发表日期:2025.01.02
研究方法:单细胞转录组(10x Chromium)、空间转录组(10x Visium)、高分辨率空间转录组(BMKMANU S1000)、免疫荧光
百迈客生物为该研究中的E65胚胎卵巢提供了BMKMANU S1000空间转录组技术服务。
研究背景
在发育中的哺乳动物卵巢中,卵泡的位置对其生物学功能具有重要影响。休眠卵泡主要位于卵巢皮质外部,对雌性生育周期长短具有重要影响,而生长卵泡则位于髓质区域,对雌性生育的起始至关重要。然而,目前对胚胎阶段卵巢微环境形成机制的理解尚不深入,这主要是由于该过程发生在胚胎期,涉及多种异质细胞类型的协同作用。
在小鼠中,原始生殖细胞从外胚层迁移到生殖脊并在性腺中增殖,随后在特定时间点沿前后轴异步启动减数分裂。最近的研究显示,这一过程与经典的维甲酸信号无关,而是通过TEX14形成细胞间桥来实现。这些发现强调了生殖细胞微环境在决定其发育命运中的关键作用。
目前对卵巢发育中卵母细胞的研究主要集中在基因表达上,但对卵母细胞在卵泡发生过程中的细微空间定位及主要体细胞类型的空间动力学特征了解有限。通过空间转录组学和单细胞RNA测序技术,该研究揭示了猪早期卵巢发育中的皮质-髓质梯度,并发现人猪之间卵母细胞空间定位的保守性,进一步强调了卵巢微环境在决定卵母细胞命运中的重要作用。
材料方法
研究材料:通过人工授精培育妊娠猪(三元杂交:Landrace、Large White和Duroc),分别在受精后45、55、65和75天采集胚胎阶段的猪卵巢样本。
研究方法:scRNA-seq(E45、E55、E65、E75胚胎卵巢,共计18,956个高质量细胞,10x Genomics Chromium);空间转录组(E45、E55、E65、E75胚胎卵巢,10x Visium;E65胚胎卵巢,BMKMANU S1000)
分析方法:空间转录组解卷积(Cell2location);RNA速度分析(Velocyto和scVelo);单细胞轨迹推断(Cellrank);同源基因转化(biomaRt);细胞通讯分析(CellphoneDB、biomaRt、ktplots);蛋白互作分析;GO富集分析;基因模块分析(Hotspot)
验证实验:免疫荧光;图像分析和定量分析;Western blotting;卵巢组织体外培养
研究结果
1.猪早期卵子发生的单细胞图谱的构建
为了深入揭示猪卵巢早期卵子发生的时空发育特征,研究者将单细胞RNA测序(scRNA-seq)与10× Visium空间转录组(ST)技术相结合,对猪卵巢发育过程中的细胞空间属性进行了系统分析。4个发育时间点(E45、E55、E65和E75;scRNA-seq各包括2个胚胎;ST:E45、E55、E65各包括2个胚胎,E75,1个胚胎),其中包括早期卵子发生的各阶段。保留了18,956个高质量细胞,共鉴定出17个聚类,包含9种主要细胞类型:生殖细胞、双潜能前颗粒细胞、上皮前颗粒细胞、性腺间质细胞、平滑肌细胞、内皮细胞、血管周围细胞、T细胞、巨噬细胞。
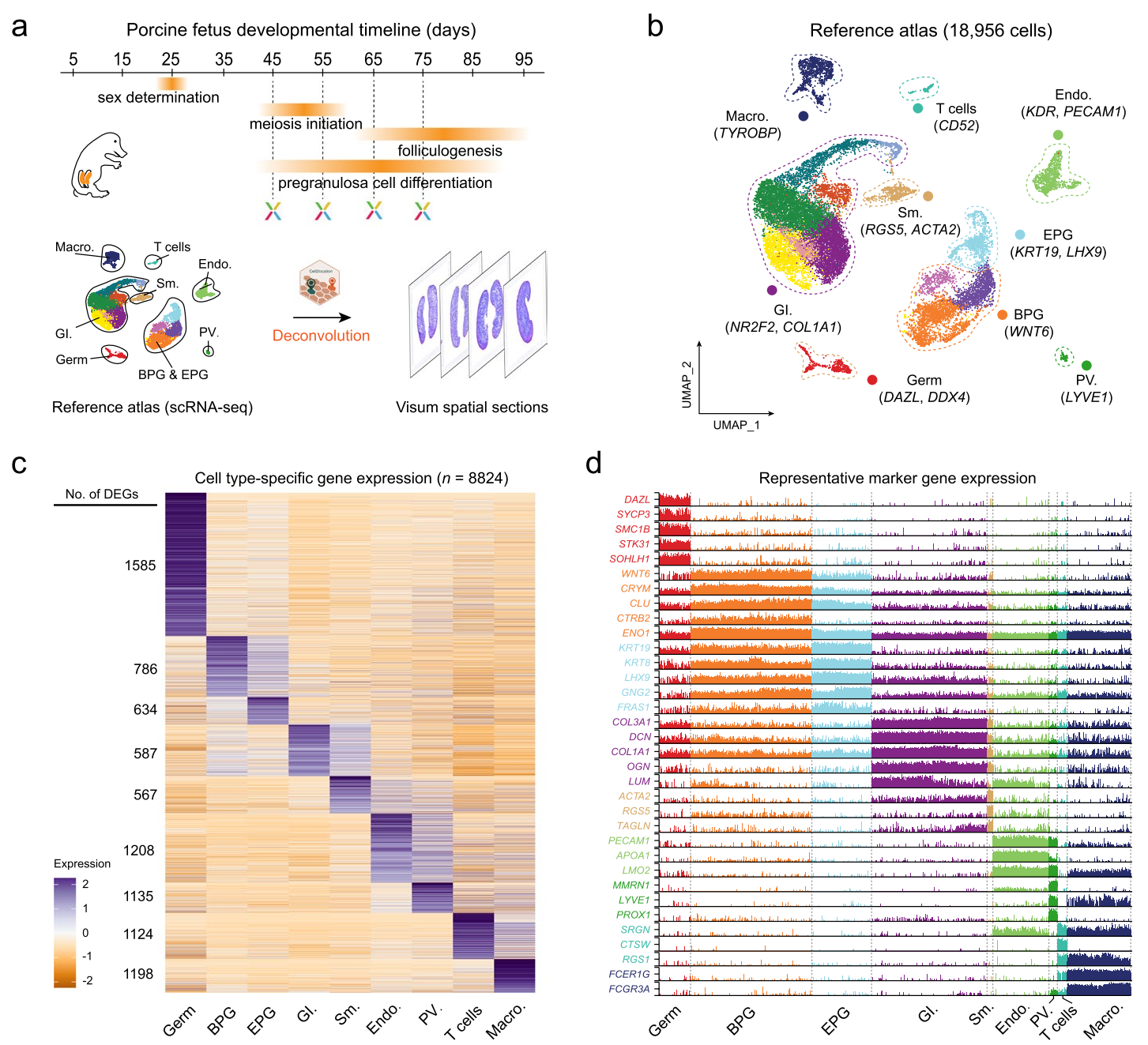
图1-发育中的猪卵巢的scRNA-seq
2.猪卵巢空间转录组的细胞类型解卷积
为了揭示卵巢发育过程中不同细胞类型的空间动态变化,研究者进行了细胞类型的解卷积分析。尽管scRNA-seq技术为剖析复杂组织中的细胞异质性提供了有力工具,但它缺乏细胞的空间位置信息。因此,研究者采用10× Visium空间转录组(ST)技术进行测序,以更好地展现猪卵巢发育过程中不同细胞类型的空间动态变化。研究者首先对ST数据进行了质量评估,确保数据质量符合分析要求。随后,利用scRNA-seq数据作为参考,通过Cell2location算法对ST数据进行了细胞类型的解卷积,实现了细胞类型的高分辨率定位。
通过解卷积分析,研究者发现在E45和E55阶段,细胞类型的空间分布相对较为“随机”。然而,随着发育进展到E65阶段,研究者观察到了一个明显的空间分布模式:生殖细胞在E45-E55阶段随机分布在猪卵巢中,而在E65-E75阶段则主要定位于皮层区域,仅有少量位于髓质区域。对于前颗粒细胞群,我们观察到了两种具有不同空间定位模式的细胞类型:BPG细胞在E55之前随机分布,并逐渐在E75时集中于髓质区域;而EPG细胞则在整个发育过程中始终位于卵巢表面。
为进一步验证分析结果,研究者进行了全组织染色实验,使用生殖细胞标志物DDX4和前颗粒细胞标志物KRT19对E45至E75的胎儿卵巢进行染色,实验结果与ST数据分析结果一致。此外,研究者还分析了这些阳性细胞在卵巢背腹轴上的空间分布,并通过荧光强度分析确认了生殖细胞和前颗粒细胞在皮层和髓质区域的不同分布模式。这些发现为深入理解猪卵巢发育过程中细胞类型的空间动态变化提供了重要线索。
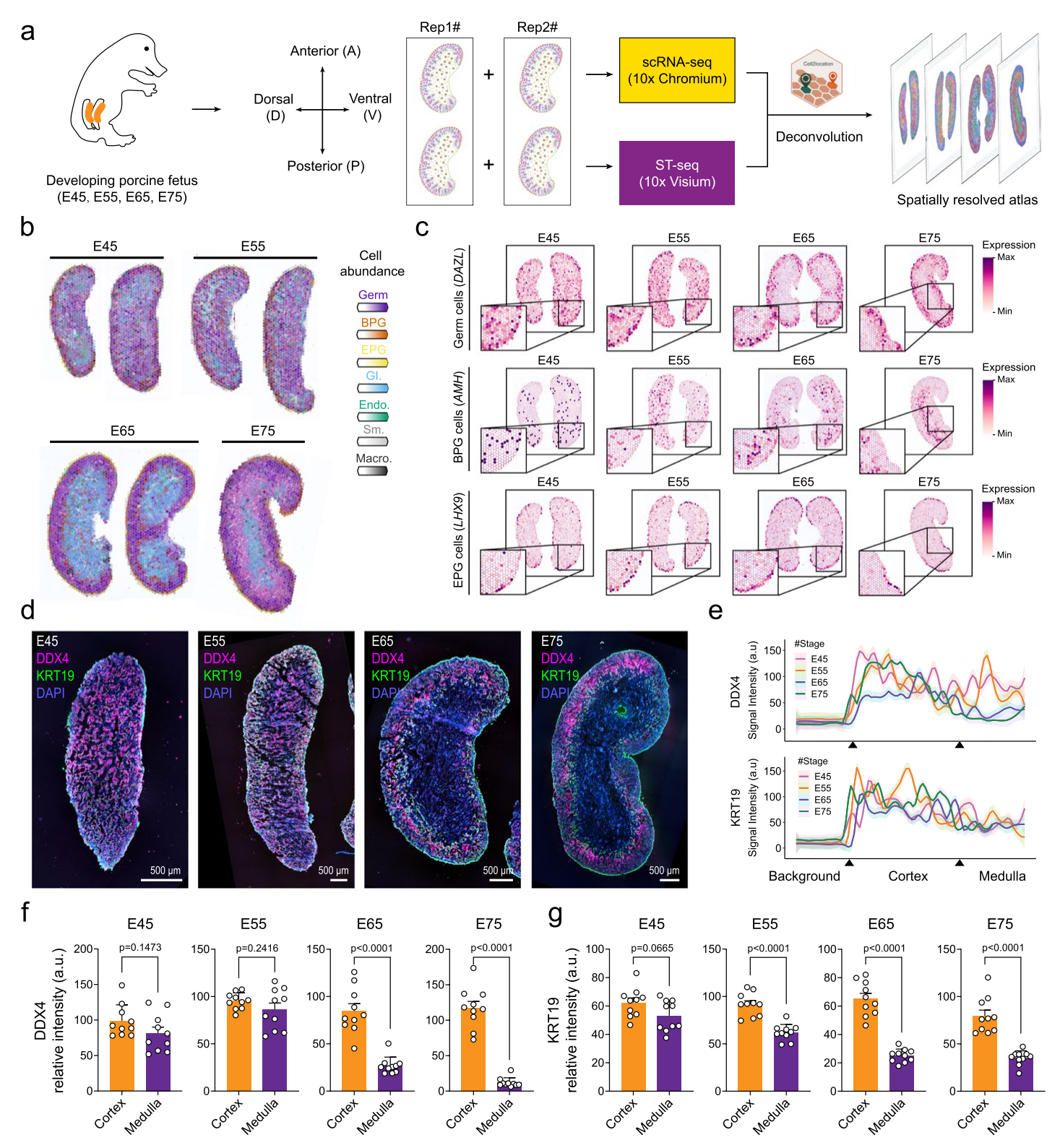
图2-基于scRNA-seq数据使用Cell2location的ST的解卷积
3.空间尺度解析精细尺度猪生殖细胞发育轨迹
为了深入理解生殖细胞在空间环境中的发育过程,研究者提取了生殖细胞进行重新聚类。通过对生殖细胞群的精细分析,研究者发现了五个对应的细胞簇,分别是有丝分裂生殖细胞(FGC_mitotic)、表达MECOM和ATM的前减数生殖细胞(Oogonia_STRA8)、表达SYCP1和DMC1的减数分裂生殖细胞(Oogonia_meiotic)、表达FIGLA和NANOS1的早期卵母细胞(Pre_oocyte)以及表达ZP4和ZP3的卵母细胞(Oocyte)。
为了深入了解早期猪卵母细胞生成过程中模块基因的功能富集情况,研究人员采用Hotspot算法,利用生殖细胞的scRNA-seq数据识别了相关基因模块,共鉴定出11个功能各异的基因模块。通过将单个模块投影到UMAP图中,确定了具有簇特异性的信息性基因模块。剖析了早期猪卵母细胞生成过程中的基因表达谱后,研究人员进一步在空间环境中研究了这一过程。通过对ST芯片上的生殖细胞进行解卷积,揭示了早期卵母细胞生成的皮质-髓质梯度。为了验证上述分析,研究人员使用生殖细胞标记DDX4和减数分裂生殖细胞细线期标记γH2AX进行了全组织染色实验,以定位在不同阶段启动减数程序的生殖细胞。评估了C-M轴的荧光强度后发现在E45和E55卵巢中,γH2AX信号沿C-M轴的水平相似,而在E65至E75卵巢中,γH2AX信号在内皮层达到峰值,在髓质区域则减少。
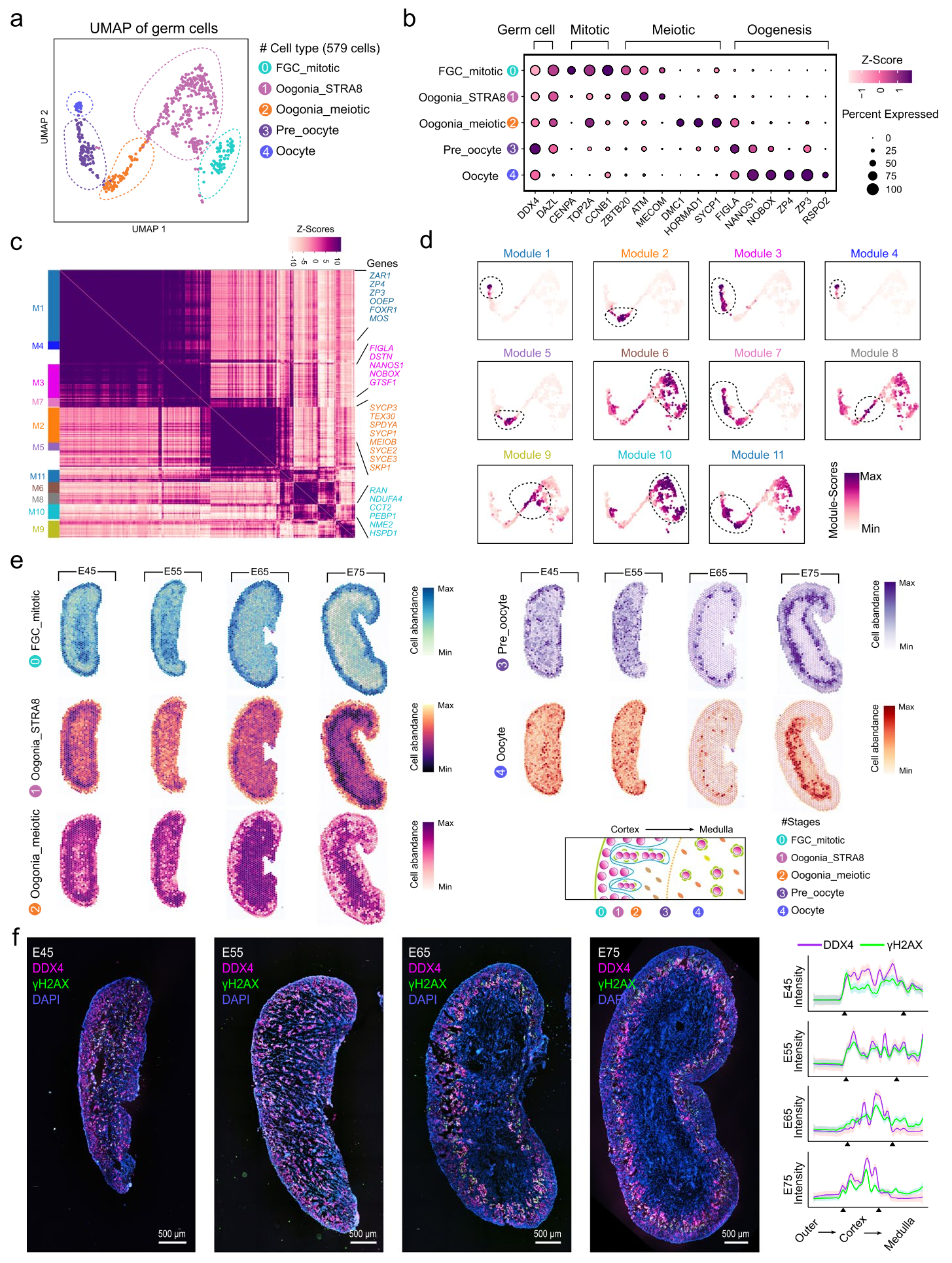
图3-使用空间转录组技术(ST)对生殖细胞空间位置模式的特征化
为了进一步验证分析,研究人员还在同一E65卵巢组织上使用了更高分辨率(BMKMANU S1000;Spot点大小约为10微米)的平台进行了ST测序。结果与E65时的Visium ST解卷积一致,使用S1000平台在E65时可视化ZP3阳性卵母细胞的空间位置也证实了其在内皮层的表达。

图4-生殖细胞异质性及空间位置模式的特征描述
综上所述,研究人员成功地在单细胞分辨率下再现了猪生殖细胞的发育过程,并阐明了猪卵巢组织中生殖细胞的空间分布模式。
4.跨物种分析揭示了猪与人类之间生殖细胞基因表达程序及空间位置模式的保守性
为了深入理解哺乳动物卵母细胞生成的空间调控机制,研究人员进行了跨物种分析。研究团队首先获取了妊娠后19周人类卵巢的空间转录组(ST)数据,并将其与猪E65时期的ST数据进行了比较,以分析卵母细胞生成各阶段生殖细胞的空间位置模式。与人类情况一致的是,生殖细胞标记DDX4与5mC和5hmC的共染色显示,在E55和E75猪卵巢中,5mC和5hmC信号在DDX4阳性细胞中不可检测,且主要在周围性腺体细胞中表达。这些结果进一步揭示,除了保守的基因表达程序外,人类和猪在早期卵母细胞生成过程中的表观遗传重编程模式也是保守的。
为了研究猪和人类早期卵母细胞生成过程中皮质-髓质梯度是否保守,研究人员基于ST数据探索了卵母细胞生成各阶段生殖细胞的空间位置模式。对于早期卵母细胞阶段的生殖细胞,这些细胞在卵巢内皮质区域有清晰定位,而在人类中,这些细胞主要位于内皮质和外髓质区域,且在内皮质区域丰度更高。到了卵母细胞阶段,猪和人类中这些生殖细胞的位置模式相似,主要位于外髓质区域。通过评估生殖细胞到卵巢表面的相对距离(以卵巢宽度标准化),观察到猪和人类早期卵母细胞生成过程均显示出生殖细胞的皮质-髓质梯度定位。这些数据不仅揭示了猪和人类早期卵母细胞生成过程中保守的基因表达程序和表观遗传重编程模式,还强调了两种物种在整个早期卵母细胞生成阶段空间动态的保守性。

图5-猪与人卵巢ST数据的跨物种比较分析
5.基于空间转录组学(ST)技术解析猪卵巢发育过程中两种颗粒细胞谱系的时空特性
在发育中的卵巢中,颗粒细胞与生殖细胞相互作用,形成了卵巢的基本功能单位,即卵泡。因此,研究人员接下来提取了颗粒细胞谱系,并使用UMAP进行了细胞聚类分析,共鉴定出10个细胞簇。分析了潜在时间基因表达动态和颗粒细胞前体发育轨迹中wave II型颗粒细胞(PreGC_II)的命运决定。与PreGC_I相比,簇6和7中的基因在PreGC_II命运决定中起关键作用,如WNT6、GREM1和SFRP4,这些结果共同强调了WNT信号分子在猪颗粒细胞前体命运决定中的保守作用。此外,ALDH1A2的上调表明,醛脱氢酶家族成员1A2可能在wave II颗粒细胞发育中发挥重要作用。
使用空间转录组学(ST)技术对wave I型颗粒细胞前体(PreGC_I)和wave II型颗粒细胞前体(PreGC_II)的标志性基因进行了空间定位。结果发现,LHX9(PreGC_I的标志)和GREM1(PreGC_II的标志)的信号从E45到E75在卵巢中呈现特定的空间分布模式。在E65和E75,GREM1的信号明显环绕着DDX4(生殖细胞的标志)的信号,表明卵巢卵泡组装的早期阶段,wave II型颗粒细胞(来源于皮质区域的颗粒细胞前体)在卵巢卵泡组装过程中发挥了关键作用。
接下来,研究人员分析了颗粒细胞谱系的空间特性,进行了细胞类型反卷积,并观察到卵巢表面上皮(OSE)细胞群主要位于猪卵巢的表面,并随着发育的进行细胞数量增加。在E45时,I型颗粒细胞前体(PreGC_I)细胞广泛分布在髓质中,部分位于皮质中;在E65时,观察到I型颗粒细胞前体(PreGC_I)和II型颗粒细胞前体(PreGC_II)分别呈现出特定的皮质和髓质分布模式。通过免疫荧光分析进一步验证了这些发现,上述结果共同揭示了猪卵巢发育过程中颗粒细胞谱系的空间时间特性。

图6-使用ST技术表征前颗粒细胞的发育轨迹及其空间定位模式
6.猪卵巢发育期间主要体细胞类型的空间特性
除了生殖细胞和颗粒细胞外,研究人员还进一步以更高分辨率分析了GI(间质细胞)和Sm(平滑肌细胞)这两种体细胞在猪卵巢中的空间分布模式,因为这两种细胞类型在猪卵巢中显示出特征性分布,表明它们可能在塑造卵巢微环境方面发挥作用,这对早期卵子发生至关重要。
将GI和Sm的标记基因整合到空间转录组学中,观察到这些体细胞的空间位置随着从E45到E75的发育进展而发生变化。通过RNA速度分析确定的分化谱系细胞和增殖状态细胞在E45和E55时的卵巢中随机分布,而在E65时,观察到这些细胞在卵巢皮质中呈现出明显的空间聚集模式,特别是在生殖细胞附近。这些发现共同揭示了猪卵巢发育早期体细胞空间位置模式的动态变化,表明它们在形成对早期卵子发生至关重要的卵巢微环境中发挥潜在作用。
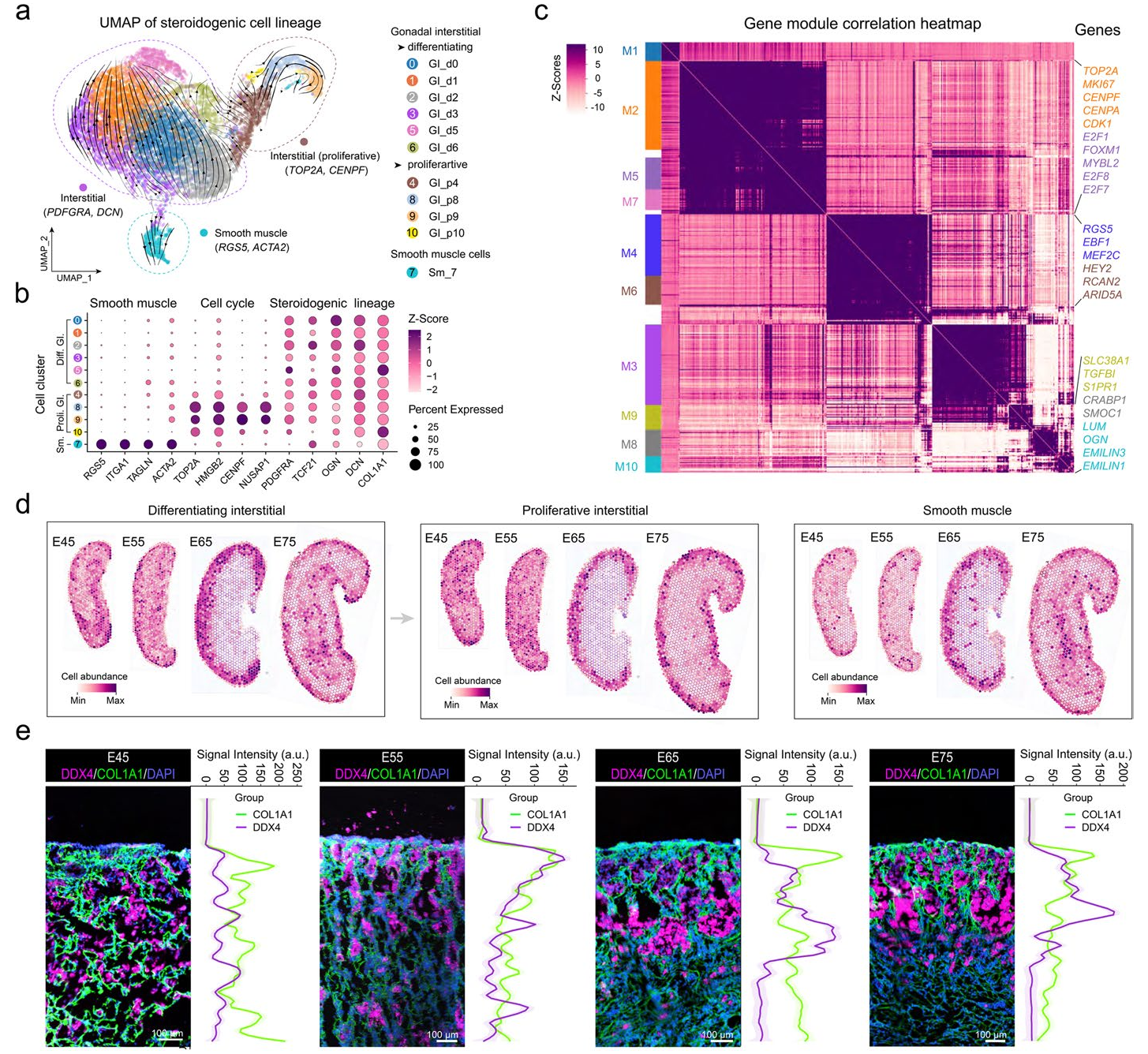
图7-利用空间转录组学(ST)表征类固醇生成细胞谱系的异质性和空间位置模式
7.空间共定位分析揭示了皮质区和髓质区存在截然不同的微环境,强调了其在调控生殖细胞命运中的关键作用
在阐明了发育中的猪卵巢中主要细胞类型的时空特征后,研究人员接下来研究了空间微环境的变化如何影响发育中卵巢的细胞命运决定。首先对细胞类型丰度进行了非负矩阵分解(NMF),以研究发育中卵巢中细胞的空间共定位。NMF分解的应用成功地表征了位于皮质和髓质的生殖细胞niche,并揭示了与不同空间来源的生殖细胞共定位的体细胞。为了全面理解细胞-细胞通信模式的功能性,研究人员使用CellphoneDB进行GO富集分析,识别了不同区域生殖细胞与体细胞之间的配体-受体(L-R)对,发现皮质和髓质区域之间细胞-细胞通信模式的功能富集结果不同。
此外,研究人员观察到皮质区域的L-R对显著富集了NOTCH信号通路,PreGC_ii0和PreGC_ii8表达NOTCH信号介导因子NOTCH2,而其配体DLK1和JAG1则在向减数分裂进程中的生殖细胞中表达,结果表明NOTCH2在猪早期生殖细胞命运决定中发挥着关键作用。在髓质区域细胞-细胞通信分析揭示了在卵细胞阶段的生殖细胞表达了参与原始卵泡组装的配体,包括BMP4和BDNF,而它们相应的受体,包括BMPR1A、BMPR1B和SORT1,则由PreGC i4和PreGC i7表达。研究人员发现髓质区域的体细胞表达了一系列细胞外基质(ECM)蛋白,而皮质区域则不是这样,表明ECM蛋白在调节猪卵母细胞生成中发挥着关键作用。
为了进一步验证细胞通讯分析,研究人员接下来探讨了在使用从E55卵巢皮质和髓质中分离的卵巢组织进行体外条件下,补充NOTCH信号抑制剂DAPT和基质金属蛋白酶抑制剂多西环素是否会影响生殖细胞命运。从E55胎儿卵巢中解剖出皮质和髓质组织,将这些组织进行体外培养,并在用DAPT处理10天后观察到皮质卵巢组织中减数分裂标志物STRA8的表达水平显著降低,而髓质卵巢组织则没有这种情况。相反,在用基质金属蛋白酶抑制剂多西环素处理10天后,观察到卵泡形成标志物LHX8的表达水平降低,而在皮质组织中未观察到可比的影响。综上所述,这些数据进一步支持了在空间背景下的细胞-细胞通讯分析,并强调了卵巢微环境在调节生殖细胞命运中的重要作用。
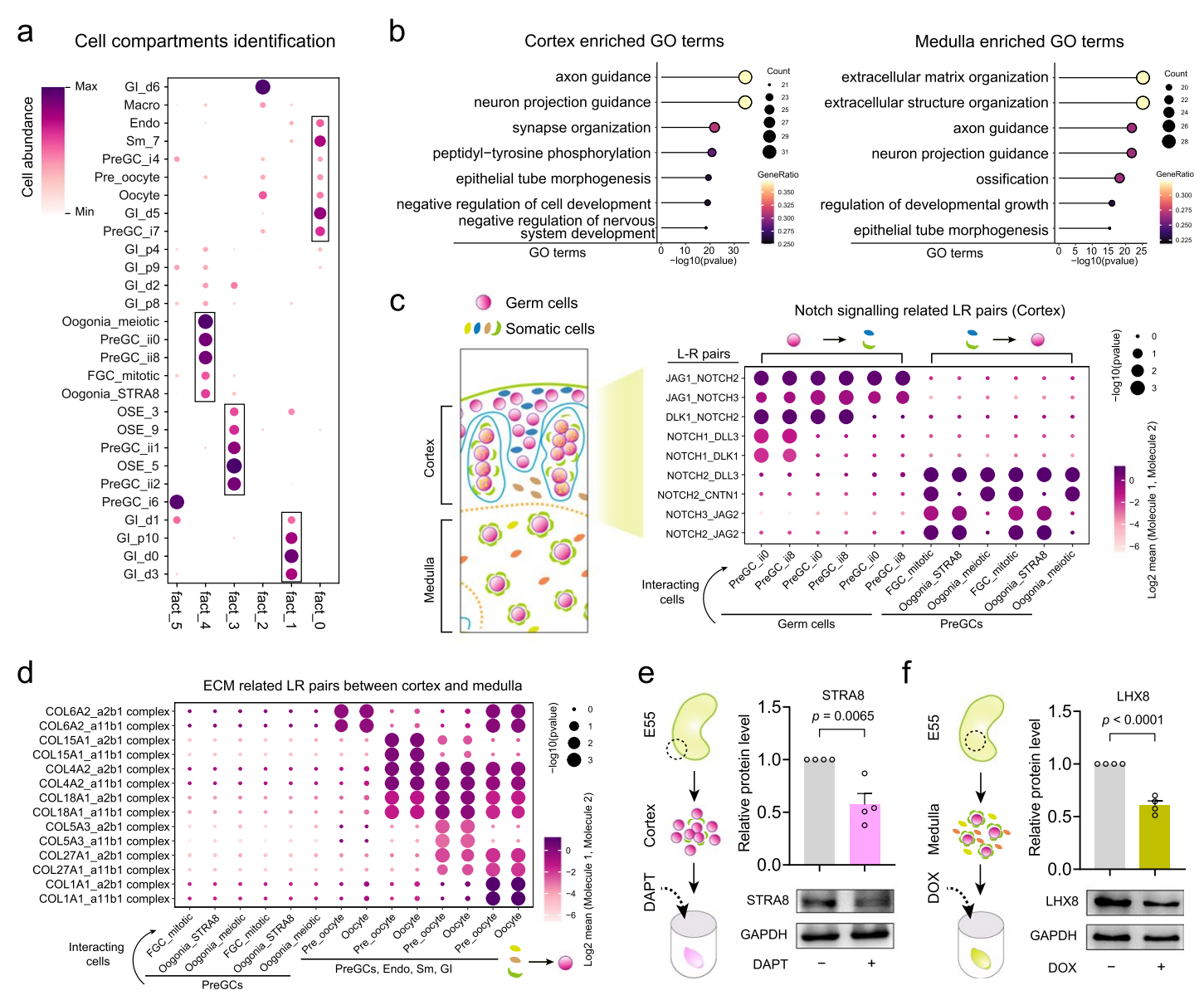
图8-卵巢皮质和髓质之间细胞-细胞通讯模式的比较
研究总结
综上所述,该研究基于单细胞和空间转录组测序,深入探讨了猪早期卵子发生过程中的时空基因表达谱和卵巢微环境的空间组织,以及这些特征在人类中的保守性。这些发现不仅丰富了我们对猪繁殖性状形成复杂机制的认识,还为生殖医学领域的研究提供了新的视角和方法。








 京公网安备 11011302003368号
京公网安备 11011302003368号