单细胞测序中,从样本制备到文库测序要经过5个技术流程:单细胞悬液制备、单细胞精准捕获&cDNA扩增、文库构建、上机测序、以及数据分析步骤。上期分享了单细胞测序1丨单细胞悬浮液制备,主要介绍了从动物组织、血液、植物组织三种样本中获取单细胞悬浮液的基本方法和注意事项。接下来分享:如何精准捕获单细胞&cDNA扩增等。
目前常见的捕获单细胞技术方法有:微流控和微孔板法。本文通过基于微流控法的平台-百创DG1000来精准捕获细胞,并进行后续的逆转录、cDNA合成与扩增、文库构建等实验,从而获得每个细胞的转录组信息。
1、芯片加样
处理好的细胞悬液尽量在30min以内上机实验,长时间放置,会导致细胞活性降低。按照一定的加样顺序,分别将细胞相、胶珠相(DG1000-3′ gel beads)、油相加入到芯片(图1:左图)对应孔中,然后将芯片放入到百创DG1000微液滴生成仪中(图1:右图),启动开关。

图1:百创C1000芯片结构(左图);百创DG1000微液滴生成仪(右图)
2、形成GEMs
仪器运行后,通过控制流速的方法,使得在“Y型”接口处,一个胶珠会吸附单个细胞及逆转录预混液一起向右流动。到了“十字”接口处,它们与油相接触后,每一个油滴中会包裹着一个胶珠与一个细胞,也就是“油包水”(GEMs)结构。

图2:形成“油包水”的原理(左);“油包水”(GEMs)结构示意图(右)。
引物结构
- 百创DG1000-3′ gel beads(胶珠)上固定的引物由4部分组成 :Read1、Cell Barcode、UMI、Poly(dT)VN。
- Read 1: 是一段已知的短核昔酸序列,主要用于后续的上机测序
- Cell Barcode:片段长度54bp,种类约为88万种,一个胶珠对应于一个特异Cell Barcode序列。
- UMI:在 mRNA反转录后,每一个mRNA随机连上一个UMI,可以通过计数不同的UMI,最终确定mRNA的数量。
- Polv(dT)VN:与mRNA3’端的poly(A)结合,进行后续的逆转录反应
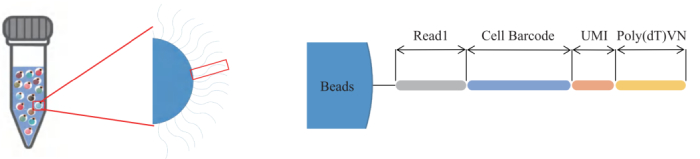
图3:引物结构示意图。
3、cDNA生成与扩增
GEMs形成后,细胞裂解释放出mRNA;同时胶珠也会自动溶解,释放出大量含有Barcode序列的引物,并利用引物末端的Ploy(dT)VN序列捕获液滴中的mRNA,并在一个个GEM中独立完成mRNA逆转录,产生带有Barcode和UMI信息的cDNA。随后“油包水”结构裂开,进行cDNA扩增。

将扩增得到的cDNA纯化后,可用于后续构建测序文库。由于每一个单细胞的cDNA文库标记上了细胞条形码(Barcode)。测序时,就把携带相同Barcode的序列视为来自同一个细胞,达到区分细胞的目的。
以上就是生成GEMs、mRNA逆转录、以及cDNA合成与扩增的全部内容。下期会具体介绍数据分析指标的意义。
单细胞平台-百创DG1000
百创DG1000是基于微流控、油滴包裹和Barcode标记等技术来实现高通量的单细胞精准捕获。除了仪器以外,百创DG1000还有配套的2×4的独立芯片及配套试剂盒。

百创DG1000部分数据展示

人PBMC

大鼠PBMC

鸡PBMC

鳖PBMC

黄颡鱼PBMC

牡蛎PBMC
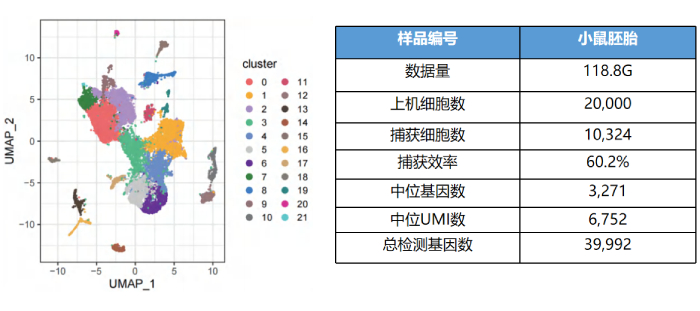
小鼠胚胎

某鱼类食道

某植物细胞核
如果您对百创DG1000单细胞平台感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。









 京公网安备 11011302003368号
京公网安备 11011302003368号